Resonancia
Una única estructura de Lewis, a veces, no da una descripción adecuada de una molécula. Así, por ejemplo, para la molécula de ozono pueden dibujarse dos estructuras de Lewis (Figura 1). Sin embargo ninguna de las dos, por separado, representa correctamente la geometría de dicha molécula. Cada una presenta un enlace simple y uno doble, cuando las dos distancias Ocentral-Oterminal deben ser idénticas (1.28 Å). Este valor aparece entre el de un enlace simple (O-O, 1.48 Å) y el de un enlace doble (O=O, 1.21 Å).
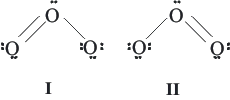
Figura 1. Estructuras de Lewis para el ozono.
Para explicar esta aparente deficiencia en la teoría de Lewis debe introducirse el concepto de la resonancia. Según éste, la estructura de una molécula puede estar representada por la suma o mezcla de todas las estructuras de Lewis posibles para la misma. La resonancia se indica mediante una flecha con doble punta:
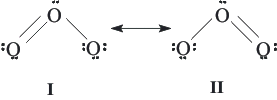
La estructura resonante debe considerarse como una mezcla de las distintas estructuras y no como un equilibrio o intercambio rápido entre ellas. En términos de la mecánica cuántica, la distribución electrónica de cada una de las estructuras se representa mediante una función de onda, siendo la función de onda real de la molécula Y, una combinación lineal de las funciones de onda correspondientes a cada una de las estructuras resonantes o formas canónicas:
Ψ = cI ΨI+ cII ΨII
Ambas funciones de onda contribuyen de igual forma a la función de onda real de la molécula Ψ porque ambas tienen la misma energía, por lo que en este caso cI = cII La estructura global se conoce como híbrido en resonancia.
La resonancia tiene dos consecuencias importantes: a) promediar las características de los enlaces de la molécula y b) reducir la energía del híbrido en resonancia, de manera que ésta será siempre inferior a la de cualquier estructura contribuyente. Así, por ejemplo, la energía del híbrido en resonancia de la molécula de O3 es menor que la de cada estructura resonante por separado.
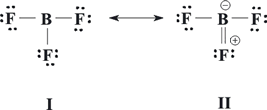
La resonancia es tanto más importante cuando existen varias estructuras contribuyentes con la misma energía, como se ha descrito para la molécula de O3. En estos casos todas las estructuras resonantes contribuyen de igual forma al híbrido en resonancia. Pero si las distintas estructuras resonantes tienen diferentes energías, la contribución al híbrido en resonancia será tanto menos importante cuanto mayor sea la energía de la estructura. Es decir, aquellas formas resonantes de menor energía se asemejan más a la forma real de la molécula. Para la molécula de BF3 se pueden escribir dos estructuras de Lewis no equivalentes, I y II. La función de onda viene dad igualmente por Ψ = cI ΨI + cIIΨII, pero en este caso cI ≠ cII. ¿Cuál de ellas contribuye más al híbrido en resonancia?.
La decisión a tomar sobre qué estructura de Lewis es la que tiene menor energía y, en consecuencia, contribuye predominantemente al híbrido en resonancia depende marcadamente de la distribución de las cargas formales sobre cada átomo. Aunque la carga total de una molécula está repartida globalmente por toda la estructura, en muchas ocasiones resulta útil adscribir una carga formal a cada átomo de la misma. La carga formal de un átomo en una estructura de Lewis se puede calcular mediante la siguiente expresión:
Carga Formal = Nv – Nps – ½ Npc
donde Nv es el número de electrones de valencia del átomo, Nps es el número de electrones en pares solitarios (o no compartidos) que presenta dicho átomo en la estructura de Lewis y ½ Npc es el número de electrones en pares compartidos (o de enlace). Es decir, la carga formal es la diferencia entre el número de electrones que posee el átomo libre y el número de electrones que posee cuando forma parte de la molécula. En un sentido ideal la carga formal indica el número de electrones que un átomo gana o pierde cuando se implica en un enlace covalente con otro átomo. La suma de las cargas formales para una estructura de Lewis es siempre igual a la carga total de la especie química.
La estructura resonante que posee la menor energía es aquella en la que: 1) las cargas formales sobre los átomos individuales son las más bajas y 2) los átomos más electronegativos soportan las cargas negativas y los menos electronegativos las positivas. Ejemplos: NO3¯ y BF3.
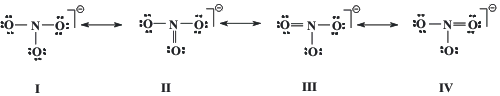
Las estructuras resonantes para la especie química NO3¯ son: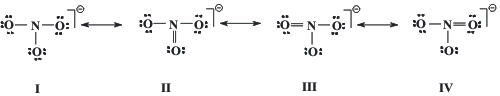
El cálculo de las cargas formales de N y O arroja los siguientes resultados. En la estructura I, cada oxígeno presenta carga formal -1 y el nitrógeno +2. En las estructuras II, III y IV, los oxígenos unidos al nitrógeno por doble enlace presentan carga formal cero y los unidos mediante enlace simple, carga formal -1. El nitrógeno presenta carga formal +1 en las tres estructuras. De acuerdo con los criterios mencionados anteriormente, estas tres estructuras son más estables que la primera, y contribuyen más al híbrido de resonancia.
En cuanto al BF3, cuyas estructuras de Lewis aparecen más arriba, es la I la que más contribuye al híbrido resonante, pues la II presenta separación de carga y además el flúor soporta carga formal positiva, siendo más electronegativo que el átomo de boro. Por ello, se puede afirmar que al ser la forma resonante I de menor energía que II, aquella contribuirá en mayor medida al híbrido de resonancia, es decir, cI > cII. La Figura 2 muestra, de forma cualitativa, el orden energético de las formas resonantes y de la estructura real para las moléculas de ozono y trifluoruro de boro. En aquella las dos formas I y II contribuyen por igual al híbrido resonante, mientras que en ésta una de las formas es más estable en términos energéticos, y por ello contribuye más a la forma resonante.
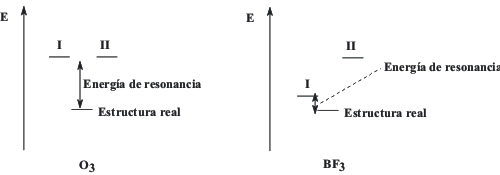
Figura 2. Orden de energía de las formas resonantes y energías de resonancia para O3 y BF3.
De la Figura anterior puede extenderse como, en el caso de que para una molécula sólo pueda escribirse una estructura de Lewis, ésa es coincidente con la estructura real, y su energía es la de la molécula real, no existiendo contribución de la energía resonante.
El número de oxidación
El concepto de carga formal se basa en la suposición de que todos y cada uno de los enlaces que forma un átomo en una molécula son de tipo covalente. Por el contrario, el número de oxidación es un concepto que nace de la situación opuesta, es decir, del carácter iónico de todos esos enlaces. Se suele definir como la carga iónica efectiva que tendría un átomo si el par de electrones del enlace perteneciera al átomo más electronegativo. Considérese de nuevo el ion NO3-:
Cada átomo de oxígeno (elemento más electronegativo que el N) posee un par de electrones más de los que presenta en su capa de valencia en estado libre (6): por ello el número de oxidación para este átomo es –2. El átomo de N no contaría con ningún electrón y su estado de oxidación es +5. Cuando a un elemento se le asigna un determinado número de oxidación se dice que ese elemento se encuentra en un estado de oxidación específico. Así, cuando el nitrógeno tiene el número de oxidación +5 se dice que presenta el estado de oxidación +5.
En la práctica, los números de oxidación se asignan aplicando las siguientes reglas:
- La suma de los números de oxidación de todos los átomos es igual a la carga total de la especie química.
- Los átomos en su forma elemental tienen números de oxidación iguales a cero.
- Los átomos de los elementos del grupo 1 poseen el número de oxidación +1. Los del grupo 2 el número de oxidación +2. Los del grupo 13, excepto el B, poseen los números de oxidación +3 y +1. Los del grupo 14, excepto el C y el Si, poseen los números de oxidación +4 y +2.
- El hidrógeno presenta número de oxidación +1 en sus combinaciones con los no metales y –1 cuando se combina con los metales.
- El flúor presenta número de oxidación –1 en todos sus compuestos.
- El oxígeno posee los números de oxidación –2 (siempre que no esté combinado con el flúor), -1 cuando está como ion peroxo, O22-, -1/2 en los superóxidos, O2¯ y –1/3 en los ozónidos, O3¯.
- Los halógenos poseen el número de oxidación –1 en todos sus compuestos siempre que no se combinen con el oxígeno u otro halógeno más electronegativo.
La hipervalencia
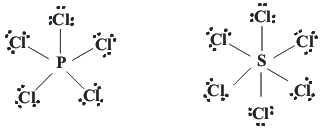
Los elementos del periodo 2 cumplen la regla del octeto, pero los del periodo 3 y siguientes muestran desviaciones de la misma. Por ejemplo, la existencia de la molécula de PCl5 sólo se puede explicar, en términos de la teoría de Lewis, si el átomo de P tiene 10 electrones en su capa de valencia. De forma similar, en la molécula de SF6, compuesto muy estable, el átomo de S debe tener 12 electrones en su capa de valencia si cada átomo de flúor está enlazado al átomo central de S mediante un par de electrones. Las especies de este tipo, para las cuales las estructuras de Lewis demandan la existencia de más de 8 electrones en la capa de valencia de uno de sus átomos, se denominan hipervalentes. Aquellas especies cuyas estructuras resonantes incluyan expansiones del octeto, pero que no necesariamente tengan más de 8 electrones de valencia, no son hipervalentes: es el caso del anión sulfato (SO4=), que presenta estructuras de Lewis desde 8 hasta 12 electrones de valencia.
La explicación tradicional de la hipervalencia y de la expansión de la regla del octeto hace uso de los orbitales d vacíos y de baja energía del átomo central, que pueden alojar los electrones adicionales. Según esta explicación, un átomo de P puede acomodar más de 8 electrones en su capa de valencia si hace uso de sus orbitales 3d vacíos. En la molécula de PCl5, por ejemplo, el P usa al menos uno de sus orbitales 3d. La ausencia de la hipervalencia en el segundo periodo es debido a la ausencia de orbitales d en el nivel 2. Un argumento más convincente para explicar esta ausencia podría ser la dificultad geométrica para acomodar más de cuatro átomos alrededor de un átomo central pequeño.

No hay comentarios:
Publicar un comentario