Un gran número de reacciones químicas transcurre con la pérdida formal de electrones de un átomo y la ganancia de ellos por otro. La ganancia de electrones recibe el nombre de reducción y la pérdida de electronesoxidación. El proceso global se denomina oxido-reducción o reacción redox. La especie que suministra electrones es el agentereductor (especie que se oxida) y la que los gana es el agente oxidante (especie que se reduce). Estos hechos muestran que las reacciones redox se asemejan a las ácido-base según la definición de Brönsted, pero en lugar de transferirse protones desde un ácido a una base, en el caso de la oxido-reducción se transfieren electrones desde el agente reductor al oxidante.
2H+ (ac) + 2e- → H2 (g) | Semirreacción de reducción |
Zn(s) → Zn2+ (ac) + 2e- | Semirreacción de oxidación |
Zn(s) + 2H+ (ac) → H2 (g) + Zn2+ (ac) | Reacción redox |
Esta separación es conceptual y no corresponde a una separación real de los dos procesos. Las especies oxidadas y reducidas de una semirreacción forman un par redox. El par se escribe colocando en primer lugar la especie oxidada y, a continuación, la especie reducida: H+/H2 y Zn2+/Zn.
Potenciales normales de reducción
Cada semirreacción contribuye con cierto valor de ΔG° a la energía libre total, siendo ésta la suma de las energías libres normales de las dos semirreacciones. La reacción global será favorable en el sentido en el que ΔG°total < 0.
Como las semirreacciones se deben producir por parejas, se puede tomar una semirreacción como referencia y darle el valor de DG° = 0, en condiciones estándar. La semirreacción que se elige es la siguiente:
2H+ (ac) + 2e- → H2 (g) ΔGº = 0
Con este convenio resulta que el valor de DG° correspondiente a la reducción del Zn2+/Zn debe tener el mismo valor que el de la reacción del Zn2+ con hidrógeno:
H2 (g) + Zn2+ (ac) → Zn(s) + 2H+ (ac) ΔGº = 147 kJ
Zn2+ (ac) + 2e- → Zn(s) ΔGº = 147 kJ
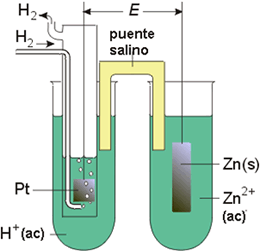
Figura 1. Pila galvánica.
Las energías libres normales se pueden obtener empleando una pila galvánica (Figura 1), en la que la reacción que impulsa la corriente de electrones por el circuito es la de interés. Así, midiendo la diferencia de potencial entre los electrodos se puede acceder al valor de la energía libre usando la siguiente expresión:
ΔG° = - nFE°
Las medidas se deben realizar en condiciones estándar, que son 1 atm de presión, 25 °C y una concentración 1 M. Como DG° es cero para el par H+/H2, su potencial estándar E° = 0. De esta manera, es posible medir el potencial de cualquier otro par redox, como por ejemplo el del par Zn2+/Zn. El potencial normal de una pila para la reacción global de una pila formada por un electrodo de H2 y el de Zn(s) será:
2H+ (ac) + 2e- → H2 (g) | Eº = 0 V |
Zn(s) → Zn2+ (ac) + 2e- | Eº = 0.761 V |
Zn(s) + 2H+ (ac) → H2 (g) + Zn2+ (ac) | Eºpila = 0.761 V |
Y, por lo tanto, E°(Zn2+/Zn) = -0.761 V y DG°(Zn2+/Zn) = +147 kJ.
Si se analiza de nuevo la reacción entre H+ y el Zn se observa que el potencial de la pila es E° > 0, lo que implica que DG°pila < 0, por lo tanto, el Zn tenderá a reducir a los H+ para dar lugar a H2(g), en condiciones normales.
La Serie Electroquímica
Un potencial normal negativo, E° < 0, denota que la especie reducida del par es capaz de reducir a los iones H+ en disolución acuosa en condiciones estándar, y producir H2. Los valores de E° a 25 °C aparecen en las Tablas de Potenciales redox. La secuencia de dicha lista sigue el orden de la serie electroquímica. En aquellos pares redox con E° muy positivo, la especie oxidada se comporta como un oxidante muy fuerte. En aquellos pares con E° muy negativo, la especie reducida actúa como un reductor muy fuerte.
Una información muy importante que se extrae de la serie electroquímica se encuentra en el hecho de que la especie reducida de un par puede reducir a la forma oxidada de cualquier par que se encuentre por encima de él en la serie. Esta posibilidad es siempre termodinámica, y no asegura que la reacción se de en una extensión aceptable pues puede ser lenta desde el punto de vista cinético.

No hay comentarios:
Publicar un comentario